生物負荷:製藥與醫材安全的關鍵角色
生物負荷 (Bioburden),也稱為生菌數或負荷菌,通常指的是產品、原材料或表面上存在的活體微生物總數量 (如細菌、真菌、病毒等)。它能有效評估和控制產品的微生物含量,不僅是確保產品品質的基石,更是保障患者與消費者安全的關鍵。
內容大綱
為什麼生物負荷測試很重要?
生物負荷的來源是什麼? 如何控制負荷菌 (bioburden control) ?
常見的生物負荷試驗流程及方法?
「 生物負荷試驗 」與「 無菌試驗 」的差異?
國內外相關規範
生物負荷測試 (Bioburden testing),又稱為生菌數測試 (total viable count, TVC) 或微生物限量(度)測試 (microbial limit testing),是製藥與醫療產業中關鍵的品質控制過程 (quality control, QC),用於偵測及量化產品在滅菌前的活體微生物含量,能夠反映原料品質、生產流程潔淨度、污染控制狀況,並作為制定滅菌參數及驗證滅菌效果的依據。
全球主要法規機構,如美國食品藥品監督管理局 (FDA) 和國際標準化組織 (ISO),都明確要求需執行生物負荷測試。例如:
- ISO 11737-1:被廣泛用作醫療器材的生物負荷測試標準,並被歐盟醫療器材法規 (EU MDR) 和 美國食品藥物管理局 (FDA 510 (k)) 認可為共識標準。
- 美國藥典USP <61>, <62>, <1115>:涵蓋非無菌產品 (nonsterile products) 微生物限度與控制策略。
生物負荷測試被廣泛應用於醫療器材、製藥、生物製劑和食品與保健品等高風險產業,做為確保產品安全與法規合規的關鍵步驟。
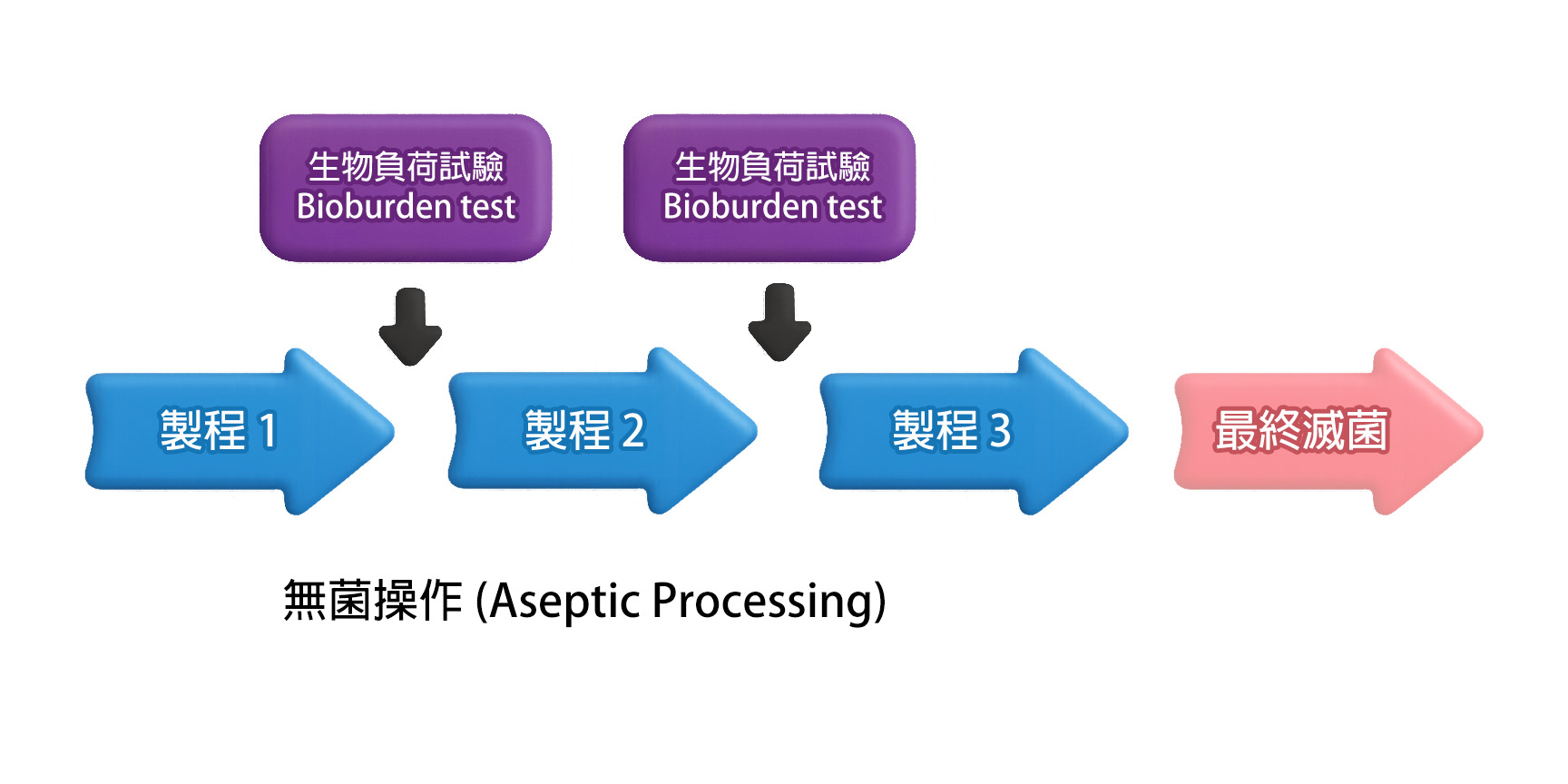
生物負荷測試一般在最終滅菌程序 (terminal sterilization) 前、或在無菌製程 (aseptic processing) 中「無菌過濾或充填步驟」前進行。測試結果所反映的微生物含量,即為整體製程潔淨度的指標。因此,生物負荷測試被視為製程潔淨驗證與污染控制策略中的關鍵步驟,其代表意義如下:
- 滅菌策略設定:
微生物的數量及類型會直接影響最終滅菌的有效性。如果生物負荷過高,即使按照標準流程進行滅菌,也可能無法完全殺死所有微生物。因此,生物負荷水平越低,產品越容易滅菌。 - 品質管理及控制:
透過定期監測生物負荷水平能確認製程潔淨度是否穩定、指出製程中的破口,並且使最終產品的微生物含量符合規範範圍內。 - 風險評估:
生物負荷有助於評估產品對患者或消費者的潛在感染風險。特別是醫療器材,若無法有效控制生物負荷,可能導致醫療相關感染 (Healthcare-associated infections, HAIs)。其特性分析有助於瞭解內毒素 (endotoxin) 的存在,即使滅菌成功,部份細菌仍會釋出內毒素,對患者健康造成潛在風險。 - 法規要求:
許多國家和地區的法規,例如 ISO 11737-1,都要求醫療器材和藥品製造商定期進行生物負荷測試,以符合相關的品質和安全標準。
生物負荷的來源是什麼? 如何控制負荷菌 (bioburden control) ?
微生物 (microbial) 可透過多種管道進入產品或原料中。從原物料、人員、設備,乃至整個製造過程,都必須透過嚴格監控,使滅菌程序發揮最大功效,製成使用安全無虞的產品。
常見的生物負荷來源及控制方式如下表所示:
| 來源 | 控制方式 |
| 原材料 | 對原材料進行微生物檢測和控制 |
| 製造環境 | 維持潔淨的生產環境,例如:使用無塵室、空氣過濾系統等 |
| 人員 | 穿著無菌服裝,並遵守嚴格的衛生程序 |
| 設備與工具 | 定期對設備和工作表面進行徹底清潔和消毒 |
| 製造過程 | 遵守無菌操作規範,並選擇產品合適的滅菌方法 |
常見的生物負荷試驗流程及方法?

1. 收集樣品與處理:
依檢品之物理特性選用適用的前處理方式,取得待測檢液。若無適用方法,則應建立適當之替代序程。
| 樣品 | 檢液配製 |
| 水溶性檢品 | 以適當緩衝液或培養基溶解 |
| 非油性不溶於水檢品 | 以適當緩衝液或培養基溶解,可添加界面活性劑 |
| 油性檢品 | 檢品溶解於適當酯類溶劑,再以預熱稀釋液稀釋檢品 |
| 噴霧式液體/固體檢品 | 將容器中檢品移入微孔濾膜過濾裝置 |
| 貼片檢品 | 具有黏性之面朝上放在無菌容器中,覆蓋無菌多孔材料,再將貼布移入適當稀釋液中,振盪至少30分鐘 |
2. 選擇適合的測試方法:
為了量化負荷菌,目前主流有四種定量分析方法,包含微孔濾膜過濾法 (Membrane Filtration Method)、傾注培養法 (又稱混合稀釋法,Pour Plate Method)、表面塗佈法 (又稱塗抹法,Spread Plate Method) 以及多重試管法 (又稱最確數法,Most-Probable-Number, MPN),請根據檢液特性選用適合的測試方法:
| 微孔濾膜過濾法(Membrane Filtration Method) | 培養皿法 / 平板法 (Plate Count Methods) |
多重試管法 (Most-Probable-Number, MPN) |
||
| 傾注平板法 (Pour Plate Method) |
表面塗佈法 (Spread Plate Method) |
|||
| 原理 | 檢液以 0.45 μm 濾膜過濾後,將濾紙置於培養基上,進行培養 | 將檢液與未凝固之培養基一起倒入培養皿中,進行培養 | 將檢液塗抹於培養基中,進行培養 | 將檢液進行至少3個連續10倍之序列稀釋,進行培養 |
| 適合樣品 | 可過濾之大量液態、生物負荷較低的樣品 | 無法過濾之樣品,如凝膠、黏膠物質等 | 無法過濾之少量樣品 | 生物負荷極低的產品 |
| 適用熱敏感物質 | 是 | 否 | 是 | 是 |
| 準確度 | 高 | 高 | 高 | 低 |
| 培養時間 | 約 5~7 天 | 約 3~7 天 | 約 3~7 天 | 約 3~7 天 |
| 結果單位 | 菌落形成單位 (CFU) |
菌落形成單位 (CFU) |
菌落形成單位 (CFU) |
依最確數表推估 |
* 一般認為多重試管法 (MPN) 是最不準確的方法,因此本法僅於無其他方法適用時才予選用。
3. 結果判定:
根據試驗結果判定產品是否符合法規標準,或用以評估最終滅菌所需之水平。
其中,微孔濾膜過濾法不僅是最常見的生物負荷檢測方法之一,也可以移除檢體中的干擾物質。若待測樣品中含有抑制微生物的生長與繁殖的成分,如抗菌劑 (antimicrobial agent) 或其他具抑菌活性 (antibacterial activity) 的成分,可能會導致檢測結果出現偽陰性 (即樣品中實際存在微生物,但因生長受抑制而未被檢出)。因此,當檢體特性適合以微孔濾膜過濾法操作時,該方法常被視為進行生物負荷試驗的首選技術。其方法是將檢液通過 0.45 μm 的濾膜,捕捉大於孔徑的微生物,再將濾膜轉置至適當培養基中培養,觀察菌落生長情形。
為加速過濾流程,ROCKER 提供多款真空過濾系統 (vacuum filtration system),皆相容 0.45 μm 濾膜,並可搭配不鏽鋼、塑料材質漏斗,專為生物負荷測試設計。
生物負荷試驗最佳首選:多連真空過濾系列,提升通量及效率
| 洛科 MultiVac 301 – MB – A 多連真空過濾系統 |
洛科 SolarVac 1201 – MB – T 旋轉多連真空過濾系統 |
|
|
|
|
|
「生物負荷試驗 」與「 無菌試驗 」的差異?
生物負荷試驗 (bioburden testing) 與無菌試驗 (sterility testing) 是醫療器材和製藥行業中,確保產品無菌性的兩個不同但相關的測試,其目的、執行時機和方法有所不同。
| 生物負荷試驗 (bioburden testing) |
無菌試驗 (sterility testing) |
|
| 目的 | 量化並監控製程中的活體微生物總量 | 確定最終產品的無菌性 |
| 執行時機 | 產品最終滅菌前的製程中設立檢查點 | 產品經最終滅菌後 |
| 操作環境 | 一般層流櫃 (laminar flow) | 無菌檢測隔離器 (Isolator) |
| 潔淨度 Class 100 (A級) | ||
| 測試方法 | 微孔濾膜過濾法 傾注平板法 表面塗佈法 多重試管法 |
微孔濾膜過濾法 直接接種法 |
| 測試對象 | 未經滅菌前的產品 非要求無菌之產品 |
最終產品 要求無菌之產品 |
| 樣器類型 | 藥品 (固體及液體) | 藥品 (固體及液體) 醫療器材 |
| 測試結果 | CFU 數值 (微生物含量) | 是/否無菌 |
| 結果應用 | 評估滅菌劑量和參數;微生物監測和趨勢分析、製程風險評估 | 驗證產品無菌性,最終放行產品的依據之一 |
| 標準依據 | ISO 11737-1 USP <61> USP <62> |
ISO 11737-2 USP <71> |
| 中華藥典 | (7007.1) 微生物計數法 (7007.2) 特定微生物檢驗法 |
(7001) 無菌試驗法 |
總體而言,生物負荷試驗是預防性和製程控制的工具,用以了解和管理產品在滅菌前的微生物含量資訊;而無菌試驗則是驗證性和品質保證的工具,目的為確認最終產品在經過滅菌處理後是否符合無菌要求
延伸閱讀:無菌試驗
國內外相關規範
生物負荷的試驗與結果判讀須依據國際標準進行,以確保結果的準確性。國際間常見標準包含:
ISO 11737-1、美國藥典 USP<61>、USP<62>、USP <1229.3>,以及藥品優良製造規範 GMP (Good Manufacturing Practice) 等。除了上述國際規範外,台灣亦有本國標準及指導文件可參考,如『中華藥典』、行政院頒布之『無菌操作作業指導手冊』等,提供實務操作與符合稽查要求的參考依據。
值得注意的是,微生物限度會依產品類型、使用途徑與滅菌方式不同而有所變動。產品若為非滅菌品,則必須證明其生物負荷處於可接受範圍,避免對人體造成危害。
應用
- 醫療器材產業:如手術刀片、導管、縫線、人工關節等
- 製藥產業:無菌注射劑、藥品原料、生物製劑 (疫苗、抗體、細胞治療產品) 等
- 食品產業:食品廠環境監控、水樣監測等
- 化妝品:產品原料
參考文獻
- Fundamentals of Bioburden testing, MERCK
- ISO 11737-1: Sterilization of health care products – Microbiological methods – Part 1: Determination of a population of microorganisms on products
- Somethin’ Buggin’ Ya? Get the Basics of Bioburden Testing, Sartorius
- Regulatory Standards for Sterility Testing, Sartorius
- USP <61> MICROBIOLOGICAL EXAMINATION OF NONSTERILE PRODUCTS: MICROBIAL ENUMERATION TESTS
- USP <62> MICROBIOLOGICAL EXAMINATION OF NONSTERILE PRODUCTS: TESTS FOR SPECIFIED MICROORGANISMS
- USP <1115> BIOBURDEN CONTROL OF NONSTERILE DRUG SUBSTANCES AND PRODUCTS
- USP <1229.3> Monitoring of Bioburden
- 中華藥典 (7001) 無菌試驗法
- 中華藥典 (7007) 非無菌產品微生物檢驗
- 食品廠環境的微生物監控,台美檢驗
- 無菌操作作業指導手冊,民96,行政院衛生署
常見問題 (FAQ)
Q1: 什麼是生物負荷測試?
A1: 生物負荷測試 (Bioburden Testing) 是用來估計材料中、或表面上活體微生物數量的檢驗方式,常見於製藥、醫療器材及食品產業中,為滅菌前的關鍵品管程序。
Q2: 生物負荷測試 與 無菌試驗 有何不同?
A2: 生物負荷測試是測量滅菌前產品中的活體微生物總量;無菌試驗則是驗證最終產品是否無菌,即測量產品經滅菌處理後是否存在微生物。
Q3: 我應該選擇哪一種測試方法?
A3: 依據樣品性質與預期微生物含量,可選擇微孔濾膜過濾法、培養皿 (即平板法) 或 MPN 法。
Q4: 生物負荷測試中的孔濾膜過濾法一定要用 0.45μm 濾膜嗎?
A4: 不一定。USP <61> 建議使用 0.45μm 孔徑濾膜過濾液態樣品,可有效捕捉絕大多數細菌。儘管 0.45µm 濾膜是微生物學方法中最常參考的濾材類型,但如果水樣中存在小型微生物,也可使用 0.2 µm 濾膜進行監測。此外,在食品和飲料行業中,由於可能需要檢測酵母和黴菌等體積較大的微生物,有時也會使用 0.8 µm 或 1.2 µm 的濾膜進行微生物分析。
Q5: 我應該選用哪一種設備進行生物負荷測試?
A5: 對於大量樣品測試,可選擇多連真空過濾系統 (如SolarVac 601 – MB – A);若為小批量測試,可搭配單座不鏽鋼濾杯使用 (如 WaterVac 101 – MB)。
Q6: 生物負荷測試需要在無菌條件下進行嗎?
A6: 是,生物負荷測試的整體操作通常需要在無菌或受控的環境中進行,以避免背景污染影響結果。









